gli equilibri tra le fasi
In un sistema eterogeneo lo stato di equilibrio è prevedibile con la regola
delle fasi, enunciata dal chimico fisico americano Josiah Willard Gibbs (1839-1903)
in base a considerazioni termodinamiche.
La regola è molto semplice:
v = c + 2 - f
v = varianza o gradi di libertà; rappresenta il numero di variabili
fisiche o chimiche che è possibile modificare senza che nel sistema scompaiano
una o più fasi
c = numero di componenti indipendenti del sistema
f = numero di fasi
2 = corrisponde alle due variabili pressione p e temperatura t
Consideriamo un sistema a un solo componente, come l'acqua. Misuriamo le coppie
di parametri p e t a cui l'acqua si presenta nelle sue varie fasi: solida,
liquida, gassosa; quindi portiamo questi dati in un grafico p/t.
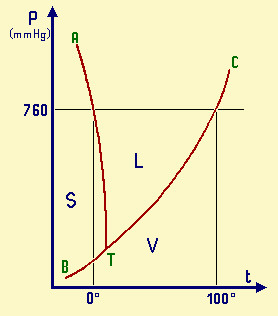
Questo grafico si chiama diagramma di stato. Ogni sostanza ha il suo e rappresenta
le condizioni di p e t in cui sono possibili i vari equilibri tra le fasi della
sostanza e le loro condizioni di esistenza.
|
Diagramma di stato dell'acqua (p/t). Il diagramma
non è in scala (dovrebbe essere molto più
allungato verso l'alto, ma se così fosse, non sarebbe evidente la curvatura
di TA verso temperature basse.
S = zona di esistenza della fase solida
L = zona di esistenza della fase liquida
V = zona di esistenza della fase vapore
BT = curva di coesistenza delle fasi solido-vapore;
corrisponde al processo di sublimazione
TC = curva di coesistenza delle fasi liquido-vapore;
corrisponde ai processi di evaporazione-condensazione
TA = curva di coesistenza delle fasi solido-liquido;
corrisponde ai processi di fusione-solidificazione
T = punto triplo di coesistenza delle fasi solido-liquido-vapore
|
|
Il punto triplo T è caratterizzato da una unica coppia di valori
per p e per t: 4,58 mm Hg e 0,01°C.
Esso non coincide col punto di fusione (p 760 mmHg; t 0,00°C),
poiché questa avviene in presenza di una p esterna, esercitata dall'aria, come
evidenziato nel diagramma.
La curva TA rappresenta così la variazione del punto di fusione
sotto l'effetto di una p esterna. Ovviamente, sopra al punto critico (temperatura
critica 374°C, pressione critica 218 atm) non può esistere equilibrio liquido-vapore
L-V, poiché l'acqua esiste solo allo stato vapore.
L'inclinazione di TA verso sinistra, al crescere della pressione,
fa capire che, se aumento la p su ghiaccio a 0°C, questo fonde (questo fenomeno
viene sfruttato, per esempio, nel pattinaggio sul ghiaccio: la pressione esercitata
dalle lame del pattino provocano una fusione superficiale del ghiaccio: il velo
d'acqua liquida permette un più facile scorrimento della lama sul ghiaccio;
quando la pressione torna al livello normale, il velo di acqua solidifica nuovamente,
stesso discorso vale per la soletta degli sci che scorre su di una lamina di
acqua). Esaminiamo il diagramma con la regola delle fasi:
Analisi del diagramma di stato dell'acqua
mediante la regola delle fasi
| al punto triplo T |
v = 1 + 2 - 3 = 0 |
sistema invariante |
| lungo le curve BT, TC, TA |
v = 1 + 2 - 2 = 1 |
sistema monovariante |
| entro le aree S, L, V |
v = 1 + 2 - 1 = 2 |
sistema bivariante |
Possiamo cioè cambiare sia pressione sia temperatura (entro certi
limiti) senza che, nel sistema, cambi il numero delle fasi, nel bivariante;
una sola delle variabili nel monovariante (determinata una variabile, l'altra
è condizionata); non possiamo cambiarne alcuna delle due nell'invariante (altrimenti
si esce dalle condizioni del punto triplo).