Il cristallo di ghiaccio
| Nell'acqua allo stato liquido questo schema non è rispettato ed un atomo di ossigeno può essere vicino a tre o più atomi di idrogeno delle molecole circostanti; allo stesso modo un atomo di idrogeno può essere circondato da due o tre atomi di ossigeno, questo perché ogni molecola si sposta rapidamente e, in uno stato di continua agitazione, cambia continuamente di posizione, sicchè le molecole possono approssimarsi le une alle altre. Questo spiega perché l'acqua aumenta di volume quando passa allo stato solido. Nel reticolo esagonale del ghiaccio ogni molecola d'acqua è simmetricamente circondata da altre quattro molecole e la distanza tra il centro di un atomo di ossigeno ed il centro dell'atomo di ossigeno vicino e rigidamente osservata (2,72 Angstrom). E' noto che, quando le condizioni di pressione e temperatura lo impongono, il vapor d'acqua condensa e si trasforma in goccioline d'acqua liquida. Se l'atmosfera è pura , il fenomeno stenta ad avviarsi, mentre è agevolato dalla presenza di determinate forme di pulviscolo, che agiscono da nuclei di condensazione, nuclei che possono essere presenti nell'atmosfera in quantità variabili da 10 a 10000 per cm3 d'aria. | |
| Sempre in via teorica quando l'acqua raggiunge la temperatura di 0°C dovrebbe solidificare, ma nella nube l'acqua resta a lungo nello stato di sopraffusione. A -10°C gela solo una gocciolina su un milione, a -30°C una su 1000, a -40 °C tutte le goccioline gelano; se la temperatura scende sotto i -20°C ogni goccia che gela può frantumarsi in due o più minuscoli cristalli di ghiaccio. Rispettando questa regola è veramente difficile che si possa produrre una precipitazione nevosa, ma il processo può essere fortemente accelerato se le goccioline collidono con un particolare tipo di pulviscolo che favorisce la solidificazione; queste particelle , presenti in concentrazioni mai superiori a 10 per cm3 sono definite nuclei di congelamento. La natura e l'origine dei nuclei è assai controversa , ma è certo che la maggior parte dei nuclei di congelamento presenti nell'atmosfera sono costituiti da polveri di argille (caolinite) Su questi nuclei il congelamento comincia a -9°C. In considerazione di quanto appena detto, non tutte le gocce d'acqua potranno solidificare e, di conseguenza, nella nube si avrà la presenza contemporanea di acqua allo stato liquido e di minuscoli cristalli di ghiaccio. |
 |
 |
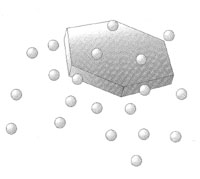
Poiché ci è noto che, a parità di temperatura, la pressione di vapore dell'acqua è superiore a quella del ghiaccio, si avrà una migrazione di molecole di acqua dalle gocce verso i granuli di ghiaccio, che costituiscono il germe intorno a cui si accrescerà il cristallo. Questo è il processo attraverso il quale si verranno a formare le infinite varietà di cristalli di neve. L'accrescimento dei cristalli di neve non avviene esclusivamente per deposito di vapor acqueo; si consideri un singolo cristallo di ghiaccio sospeso nell'atmosfera e circondato da gocce d'acqua sopraffusa e si comprende come il cristallo possa collidere con le gocce che lo attorniano, specie se ha assunto discrete dimensioni rispetto a quelle gocce. |
| Ma l'acqua che giunge a contatto è fortemente raffreddata, quindi si trova in condizione di instabilità di stato, ed anche il cristallo è freddissimo; al momento del contatto l'acqua solidificherà immediatamente sulla superficie dello stesso, conservando la sua forma. Questo processo è detto brinamento e lo strato di brina tenderà a mascherare le forme originarie del cristallo. In una nube il cristallo che cade deve raggiungere una certa dimensione per potere avere apprezzabili probabilità di collisione. L'accrescimento per sublimazione del vapore aumenta le dimensioni del cristallo verso i lati, rallentandone la caduta, mentre l'accrescimento per collisione aumenta le dimensioni soprattutto nella parte inferiore, senza aumentare la resistenza all'aria. Si tratta di un processo che tende ad accelerarsi e qunto è più veloce la discesa del cristallo, tanto sono maggiori le probabilità di collisione. I cristalli accresciutisi in questo modo hanno sovente una forma tondeggiante, più o meno irregolare, simile a quello della grandine, ma ne differiscono non solo per l'aspetto opaco, contro quello traslucido della grandine; se stretti tra le dita si sbriciolano, rivelando un interno cavo, mentre i grumi di ghiaccio e la grandine sono sferule piene. La neve così formatasi prende il nome di neve pallottolare o di nevischio granulare. La maggior parte delle precipitazioni nevose non è costituita dalla caduta di singoli cristalli di neve, ma da un insieme di più cristalli agglomerati in falde o fiocchi che possono assumere anche discrete dimensioni; il fenomeno di aggregazione è agevolato da condizioni di temperatura relativamente elevata. |
 |
| LA TENSIONE DI VAPORE | |
|
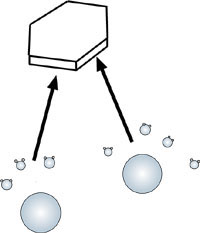
Intorno ad una goccia d'acqua, come intorno ad un cristallo di ghiaccio , anche a temperature bassissime, orbita sempre un certo numero di molecole di vapor d'acqua; ovviamente tale quantitativo di molecole è tanto maggiore quanto più è elevata la temperatura. Questo numero di molecole, che non può superare un determinato valore di saturazione, detto tensione di vapore, a parità di temperatura è sempre superiore nei pressi della goccia d'acqua rispetto al ghiaccio, perciò quando coesistono una goccia d'acqua ed un cristallo di ghiaccio nel medesimo ambiente , un certo numero di molecole migra dalla nube che avvolge la goccia verso il cristallo , sublimando alla superficie di questo. Il processo può continuare sino alla totale scomparsa della goccia d'acqua. |
|
 |
|