Ad ogni istante, in qualche punto cielo, miliardi di miliardi di molecole di vapor d'acqua si associano e si organizzano in strutture cristalline che per complessità ed eleganza di forme, non cessano di stupire neppure gli addetti ai lavori.
Come nasce la neve
| Per comprendere perché i cristalli di neve si presentano in una infinita varietà di forme occorre conoscere alcune caratteristiche dell'acqua partendo innanzi tutto dalla composizione della molecola e facendo quindi ricorso ad alcune nozioni di fisica dell'atomo. L'atomo é la particella elementare di ogni elemento chimico e nella suo concezione più elementare, é composto da un nucleo centrale formato do particelle dette protoni con corica elettrica positiva ed eventuali oltre particelle prive di corico elettrica e perciò dette neutroni. Intorno al nucleo centrale orbitano altre particelle, molto più piccole, con corico elettrica negativa dette elettroni. Il numero degli elettroni é eguale o quello dei protoni, sicché le cariche elettriche si compensano e l'atomo é elettricamente neutro. Gli elettroni non possono orbitare casualmente intorno al nucleo centrale, ma sono organizzati secondo rigide regole: come i velivoli in cielo debbono rispettare determinati corridoi di volo (quota e direzione) e non più di un certo numero di velivoli può impegnare un determinato corridoio aereo, così gli elettroni rispettano determinati orbitali che li pongono a quote e rotte diverse intorno al nucleo. |
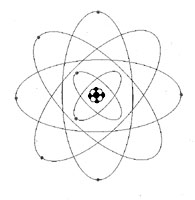 |
| Un primo strato può ospitare al massimo solo due elettroni, un secondo strato ne può ospitare otto un terzo diciotto, e così via; pensiamo ad una cipolla per avere un'idea di come gli strati di orbitali avvolgono il nucleo. | |
|
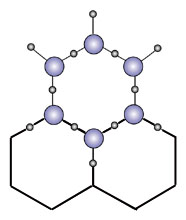
La molecola di H2O
|
|
|
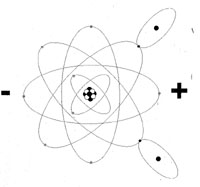
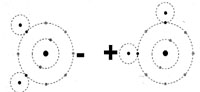
L'acqua é una sostanza dalle caratteristiche straordinarie, l'unica sostanza sullo Terra capace di essere presente nello stesso luogo in tutti e tre gli stati di aggregazione molecolare (solido - liquido - gassoso) entro una gamma abbastanza estesa di valori di temperatura e pressione. Una molecola d'acqua é composta da due gas, combinati insieme nelle proporzioni di un atomo di Ossigeno e due di Idrogeno e, con notazione scientifica, viene identificata con la formula H2O. Cominciamo con lo studio dell'atomo di idrogeno: é il primo elemento del sistema periodico, il più semplice essendo costituito da un nucleo, formato da un solo protone, intorno al quale orbita un solo elettrone. L'Ossigeno invece occupa l'ottavo posto del sistema periodico ed ha un nucleo composto da 8 protoni ed 8 neutroni. La distribuzione degli elettroni intorno al nucleo risponde alle precise regole già accennate: due elettroni ruotano in un primo strato, prossimo al nucleo, altri sei in uno strato più esterno. Le immagini cercano di rappresentare schematicamente i due atomi, ma si tenga presente che la realtà é ben diverso dalla rappresentazione grafica se non altro per il fatto che l'immagine é disegnato sul piano mentre l'atomo si sviluppo nello spazio. A rendere più complesse le cose si deve aggiungere che entrambi i gas hanno due isotopi, cioè esistono degli atomi di idrogeno il cui nucleo comprende non solo un protone, ma anche uno o due neutroni. Egualmente esistono degli atomi di ossigeno che, nel nucleo, comprendono otto protoni e nove o dieci neutroni; in tutti i casi la carica elettrica del nucleo non cambia, ma la massa dell'atomo é aumentata. L'acqua che nella sua molecola contiene atomi di Deuterio (idrogeno con un neutrone nel nucleo) é detta acqua pesante ed é utilizzata nei laboratori di fisica atomica; per quanto piuttosto rara in natura, é relativamente abbondante in alcuni laghi alpini o del nord Europa (durante l'ultima guerra i tedeschi invasero la Norvegia per aver la possibilità di estrarre acqua pesante dai numerosi laghi di questo paese). Gli isotopi dell'idrogeno prendono i seguenti nomi: Idrogeno 1H 0,76 % in peso della crosta terrestre Deuterio 2 H circo un atomo ogni 6000 di idrogeno Trizio 3 H estrema mente raro Gli isotopi dell'ossigeno sono: Ossigeno 16O 48,60% della crosta terrestre Ossigeno 17Opiuttosto raro in natura Ossigeno 18O piuttosto raro in natura Il numerino in alto o sinistra del simbolo chimico indica quanti nucleoni (protoni e neutroni componenti il nucleo) sono presenti nell'atomo. Combinando insieme tutti gli isotopi dell'ossigeno e dell'idrogeno per formare uno molecola d'acqua ci si accorge che si possono ottenere ben 18 diverse molecole simili nello formula chimico, ma diverse per mossa ed altre proprietà. Osservando il secondo strato di elettroni dell'atomo dell'ossigeno, si può notare che contiene sei elettroni, contro gli otto che potrebbero esservi ospitati; egualmente l'idrogeno ha un solo elettrone, mentre il primo strato ne può contenere due Lo strato esterno di questi atomi potrebbe accettare ancora elettroni la patto di rispettare le condizioni di equilibrio elettrico di tutto l'atomo). Ciò si può verificare o trasformando la materia les: fusione dell'idrogeno per formare un atomo di Elio = bomba H) oppure combinando insieme più atomi i cui strati di elettroni esterni si integrino a vicenda, come nel caso dell'acqua, in cui ogni elettrone dei due atomi di idrogeno può orbitare intorno al nucleo integrandosi can quelli dell'ossigeno. Come si può notare nell'immagine, i due atomi di idrogeno si sono sistemati o loto dell'atomo di ossigeno in modo asimmetrico, infatti sono disposti secondo un angolo di 105° e, a titolo di curiosità aggiungeremo che il nucleo dell'O dista dal nucleo dall'idrogeno 0,9 Angstróm (un Angstrom = 0,00000001 cm, ovvero un centomilionesimo di centimetro |
|
 |
 |
| Questa struttura dell atomo organizza le cariche elettriche in modo tale che la carica positivo dei protoni Idrogeno si trova spostata verso un lato della molecola, mentre le cariche negative dello nube di elettroni sono verso il lato opposto questo sistemazione delle particelle atomiche posto in evidenza dai segni positivo e negativo dell'immagine, fa sì che la molecola si comporti come un dipolo Per quanto si sia ben lontani dai conoscere con esattezza la collocazione degli atomi nella molecola dell'acqua, si ho la convinzione che la disposizione delle cariche elettriche rispetti quanto detto sopra. La conseguenza é che quando più molecole di H20 solidificano, le forze di attrazione-repulsione delle cariche elettriche debbono essere rispettate e l'unico modo in cui le molecole possono organizzarsi é quello di disporsi secondo lo schema di cristallizzazione del sistema esagonale, come illustra la figura che, ancora una volta, si limita a schematizzare un piano un solido che si sviluppa nello spazio lungo i tre assi. Volendo rappresentare nello spazio la disposizione degli atomi di H20 si deve immaginare un tetraedro in cui il centro ed i quattro vertici siano occupati da una molecola d'acqua. | |
 |
 |